 Terug naar
de inleidende pagina.
Terug naar
de inleidende pagina.De alkalimetalen natrium
en kalium reageren beide heftig met
water, waarbij het zeer licht ontvlambare waterstofgas vrijkomt.
Omdat beide metalen een kleinere dichtheid hebben dan die van
water, ontstaat er een bolletje van (gesmolten) metaal, dat mede
door de gasontwikkeling, over het water "scheert". In sommige
gevallen eindigt de reactie met het uiteenspatten van het
metaalbolletje.
Een veiligheidscherm (spatscherm) biedt daarbij niet altijd
soelaas.
Anderszijds komen ook ongelukken voor waarbij het waterstof is betrokken: dit gas kan zich, tijdens de reactie van b.v. natrium met water, ophopen boven het wateroppervlak. Dit gebeurt bij hoge opstellingen (b.v. een hoog standglas), waarin zich relatief weinig water bevindt. Zo bestaat er een grote kans op een explosie, vooral als de opstelling wordt afgedekt.
 Terug naar
de inleidende pagina.
Terug naar
de inleidende pagina.
Als een stukje natrium klein genoeg is kan de reactiewarmte voldoende worden afgevoerd, zodat het (en het vrijgekomen waterstof) niet ontbrandt. Bij een te groot stuk natrium kan het metaalbolletje uiteenspatten.
Erger is dit bij kalium. Deze
stof is reactiever dan natrium
waardoor de reactie nog heftiger verloopt. Kalium (en het vrijgekomen waterstof)
brandt direct met een bleek violette vlam. Deze reactie
eindigt steevast door het uiteenspatten of een kleine explosie
(ook als er slechts een klein stukje van het metaal is
afgesneden).
Natrium kan hetzelfde gedrag tonen
bij de reactie met water als kalium,
door eerst een stukje filtreerpapier op het water te laten
drijven en vervolgens een stukje natrium op het papier te
brengen. Het metaalbolletje zal gaan branden met een fel gele
vlam, waarna er met zekerheid een kleine explosie plaatsvindt.
In de laatste fase van de reactie met water, n.l. het uiteenspatten, schuilt een gevaar. De reactie verloopt doorgaans onvoorspelbaar, omdat het nauwelijks is vast te stellen of de afmeting van het stukje metaal klein genoeg is.
Anderzijds heeft lithium gunstiger eigenschappen. Het is minder reactief dan natrium.
Ook het waterstofgas dat tijdens de reactie van natrium met water ontstaat, levert gevaar op. Als dit gas niet snel genoeg wordt afgevoerd kan er een explosief waterstof/lucht mengsel ontstaan. Ernstige verwondingen, veroorzaakt door rondvliegende glasplinters, zijn vaak het gevolg van dit soort explosies.
Enige vorm van opsluiting van natrium tijdens de reactie met water (bijvoorbeeld in een reageerbuis of bij gebruik van een natriumtang) blijkt een bron van ongelukken te zijn.
Een ander aspect dat optreedt tijdens de reactie van alkalimetalen met water, is de vorming van een nevel van natrium- of kaliumhydroxide. Deze nevel is zeer goed aantoonbaar, bijvoorbeeld met een gasvlam dat geel oplicht of een vochtig rood lakmoespapiertje dat blauw wordt. Deze nevel is schadelijk voor de gezondheid.
CASUS:
REACTIE VAN NATRIUM MET WATER 1.
"..Bij een demonstratie in de zuurkast, waarbij ik een stukje
natrium met water liet reageren, explodeerde het stukje natrium.
Een minuscuul klein brokje natrium passeerde het scherm van de
zuurkast en kwam alsnog terecht kwam op de kleding van een
leerling!..."
Bijdrage: Ben Dijkhuis, 23 november 1999.
CASUS:
REACTIE VAN NATRIUM MET WATER 2.
"..Ik heb die proef eens in een gootsteenbak gedaan, gelukkig
met een stuk pantserglas erboven. Het bolletje natrium ging
eerst als een gillende keukenmeid over het wateroppervlak, en
ontplofte vervolgens met een behoorlijke knal. Het glas zat
onder het metallisch natrium, dat meteen weer reageerde met het
eveneens op het glas gespatte water. Linke soep dus.."
Bijdrage: Paul Dolk, 24 november 1999.
CASUS:
REACTIE VAN NATRIUM MET WATER 3.
"..Tijdens mijn verblijf in Botswana heb ik daar
scheikundelessen gegeven. Daar ben ik getuige geweest van een
proefje met natrium in water met ernstige gevolgen.
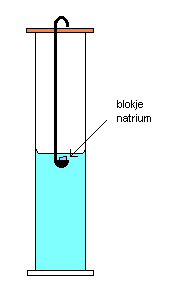 Het
proefje werd uitgevoerd volgens een Engelse methode. Men maakte
daarbij gebruik van een standglas, waarin zich een hoeveelheid
water bevond. Verder gebruikte men een plankje (dat als een
soort deksel voor het standglas diende), waaraan een soort lange
lepel was verbonden. Het stukje natrium werd in de lepel gelegd
waarna het geheel op de maatcilinder werd gezet, zodat deze door
het plankje werd afgesloten. Het blokje natrium in het lepeltje
kwam zo in contact met het water in de maatcilinder.
Het
proefje werd uitgevoerd volgens een Engelse methode. Men maakte
daarbij gebruik van een standglas, waarin zich een hoeveelheid
water bevond. Verder gebruikte men een plankje (dat als een
soort deksel voor het standglas diende), waaraan een soort lange
lepel was verbonden. Het stukje natrium werd in de lepel gelegd
waarna het geheel op de maatcilinder werd gezet, zodat deze door
het plankje werd afgesloten. Het blokje natrium in het lepeltje
kwam zo in contact met het water in de maatcilinder.
De reactie was behoorlijk heftig, zodat men zelfs va een kleine
explosie kon spreken: De glazen cilinder sprong kapot, zodat de
glasscherven in het rond vlogen. Vier personen raakten gewond
door snijwonden en stukken glas die zich in het lichaam
priemden. Zij moesten allen worden behandeld in het ziekenhuis:
de docent, die onbeschermd voor de proefopstelling stond en drie
leerlingen die achter een spatscherm stonden. Tussen deze
spatscherm en de tafel bevond zich een kier, waarlangs de
glasscherven vlogen.
Sindsdien ben ik nog steeds huiverig als er een proefje met
natrium wordt gedaan.."
Bijdrage: Frank Postma, 1 juli 2000.
CASUS:
REACTIE VAN NATRIUM MET WATER 4.
"..Het zal begin jaren '80 geweest zijn, dat mijn
scheikundedocent het proefje met natrium zelf deed. Hij pakte
zoals altijd een aquariumglas en vulde dat met water. Echter
maar voor de helft. Hij nam tevens een stukje natrium dat niet
al te klein was en deed het in het water. Gevolg: de bovenste
helft van het glas vulde zich met waterstof. Nadat ook nog eens
het natrium opvlamde, explodeerde het geheel. Doordat het een
flinke explosie was vonden we achteraf glassplinters van wel 10
cm achter in de klas! Wonder boven wonder was niemand geraakt!
De stukjes natrium die ik nu gebruik zijn dan ook behoorlijk
klein. En de bak is helemaal gevuld met water..."
Bijdrage: J.A.W. Lemmens, 16 oktober 2000.
CASUS:
HET GEBRUIK VAN EEN NATRIUMTANG EN HET
OPSLUITEN VAN NATRIUM.
"..Er is een tijd geweest dat je natriumtangen kon kopen, een
soort kleine kooi waarmee een stukje natrium onder water
gehouden werd zodat het waterstof kon worden verzameld. In de
loop der jaren hebben we een aantal ongelukken vernomen vanwege
het gebruik van deze tang. Ze worden niet meer verkocht en wij
adviseren scholen die dit soort tangen nog hebben om deze weg te
doen.....Andere manieren om natrium op te sluiten zijn op
dezelfde wijze gevaarlijk, bijvoorbeeld door natrium te laten
reageren in reageerbuizen of kleine bekerglazen..."
CASUS:
ONGELUK TIJDENS OPRUIMEN.
"..Twee jaar geleden ging er bij ons iets mis. Een lerares deed
alles volgens de regels, nam een stukje natrium en deed dat op
een filtreerpapiertje in een bekerglas van 1 liter dat met water
was gevuld. Er ging een gaasje op en het geheel stond in de
zuurkast. Alles ging goed totdat er werd opgeruimd. De docente
spoelde het bekerglas om, toen bleek dat er nog stukjes natrium
in zaten. De stukjes spatten weg. Gelukkig droeg zij een bril
want de stukjes kwamen in haar gezicht terecht, ter hoogte van
haar wenkbrauwen. Maanden heeft zij met littekens in haar
gezicht rondgelopen. Achteraf was zij zich wel bewust van de
waarschuwingen die ik haar had gegeven en dat zij op de hoogte
was van hoe ze de proef had moeten uitvoeren..."
Bijdrage van Yvonne Dijkstra, 20 november 2000.
CASUS:
KIJKEN ACHTER HET RAAM.
"..Er werkt dit jaar een nieuwe docent op school. Hij liet, op
zijn vorige school de TOA, buiten, een lekker groot brok natrium
in een emmer gooien, terwijl de leerlingen door het raam keken.
Volgens hem was dat wel veilig. Nu is er bij ons op school geen
TOA meer bereid om het proefje om deze manier uit te voeren. En
ook de docent raakt er langzaam maar zeker van overtuigd dat het
toch maar niet zo moet..."
Bijdrage van Yvonne Dijkstra, 20 november 2000.
CASUS:
DAMP VAN NATRIUMHYDROXIDE.
"..Zover ik nu inschat zijn er docenten en toa's die natrium
met water laten reageren in het lokaal. Sommigen hebben daarbij
het bewuste of onbewuste doel om natrium(hydroxide) deeltjes aan
te tonen met behulp van geelkleuring van een gasvlam of een rood
lakmoespapiertje. Het lijkt mij niet raadzaam om op deze manier
te werken. De nevel bestaat uit deeltjes natriumhydroxide.
Natriumhydroxide heeft een lage MAC-waarde (2 mg/m3),
die aangeeft dat we hier te maken hebben met een zeer
schadelijke damp..."
Bijdrage auteur, naar aanleiding van een discussie in de toa_poa discussiegroep.